转自重症沙龙
ECMO关于重度低氧性呼吸衰竭的抢救
近期天气转凉是各类肺部疾病的高发季,不少医院的呼吸科、急诊科等科室都接诊了诸多身患肺部疾病的患者。在诸多肺部疾病的治疗中,一个重要的难点就在于如何应对各类原发病及并发症引发的呼吸衰竭。自1960年首例ECMO运用于新生儿低氧血症性呼吸衰竭至今,数十年的积淀ECMO技术不断发展和改进,今天的我们可以利用ECMO这一神器在更多呼吸系疾病的领域挽救患者的生命,今天的分享一来是为了近两日问卷调查中普遍提出的高频问题,一方面也是希望今天的内容能够帮最近时常在临床面临此类的医师提供一些诊治思路。问卷调查活动进行中,希望各位从事体外生命支持的同仁积极参与进来,加深了解共同进步。体外膜氧合(ECMO)已被用作对传统治疗难以治疗的严重心肺衰竭患者的挽救疗法。ECMO于1960年代首次用于治疗新生儿低氧血症性呼吸衰竭。基于在这一人群中的成功,ECMO在1970年代初开始用于治疗成人低氧血症性呼吸衰竭。然而,成人的结果有些令人困惑。到1980年代,在儿科人群之外,很少将ECMO用于严重低氧血症。但是,ECMO技术不断发展和改进。在过去的三十年中,文献报道出现了多个病例报告和少量系列文章,描述了ECMO用于从各种肺部疾病严重低氧血症的成年人中救助的方法。急性呼吸窘迫综合征(ARDS)通常是影响成人并导致低氧血症性呼吸衰竭的各种病理的最终常见途径。自1967年首次描述以来,它在全世界的重症监护病房中很普遍,并且死亡率很高。尚未发现针对ARDS的特定疗法,目前的治疗主要是通过机械通气来支持。然而,最近随机对照试验的结果表明,ECMO可能在这些患者的治疗中占有一席之地。本文对这些研究进行回顾,并建议将重度ARDS加入低氧血症性呼吸衰竭患者的既定适应证中。自1967年首次描述以来,它在全世界的重症监护病房中很普遍,并且死亡率很高。尚未发现针对ARDS的特定疗法,目前的护理主要是通过机械通气来支持。然而,最近随机对照试验的结果表明,ECMO可能在这些患者的治疗中占有一席之地。本文对这些研究进行回顾,并建议将重度ARDS加入低氧血症性呼吸衰竭患者的既定适应证中。自1967年首次描述以来,它在全世界的重症监护病房中很普遍,并且死亡率很高。尚未发现针对ARDS的特定疗法,目前的护理主要是通过机械通气来支持。然而,最近随机对照试验的结果表明,ECMO可能在这些患者的治疗中占有一席之地。本文对这些研究进行回顾,并建议将重度ARDS加入低氧血症性呼吸衰竭患者的既定适应证中。提示ECMO可能在这些患者的治疗中占有一席之地。本文对这些研究进行回顾,并建议将重度ARDS加入低氧血症性呼吸衰竭患者的既定适应证中。提示ECMO可能在这些患者的治疗中占有一席之地。本文对这些研究进行回顾,并建议将重度ARDS加入低氧血症性呼吸衰竭患者既定适应证中。
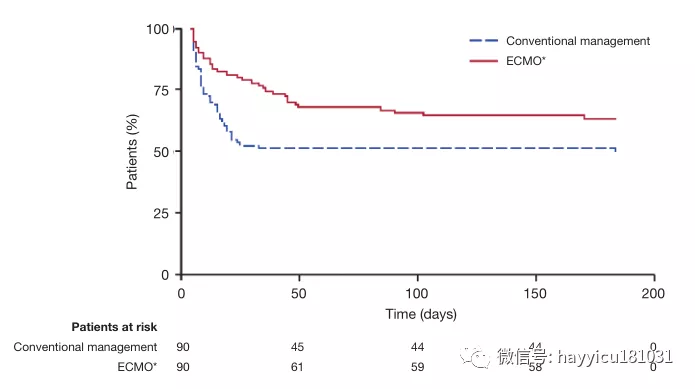
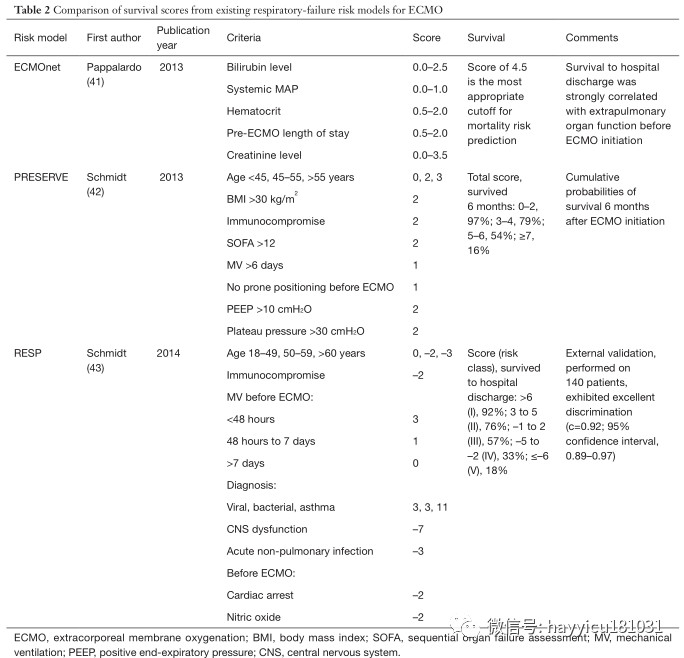
新生儿 ECMO作为严重心肺衰竭患者的挽救疗法已经使用了50多年,而传统治疗难以耐受。在1930年代后期,约翰·吉本(John Gibbon))目睹一名年轻患者因肺栓塞致死后,开始尝试体外血液循环系统,这些血液循环系统可能暂时支持心肺功能。他假设有效的回路可能允许对危及生命的栓塞进行外科血栓切除术,甚至可能对心脏进行手术。经过二十多年的艰苦实验,长臂猿首次成功地使用了这种体外循环,成功闭合了一名18岁女性的大房间隔缺损。但是,他的设备以及那个时代的类似设备要求血液和气体之间直接接触,这会破坏血液成分,因此一次只能使用几个小时。1944年发表的一项有趣的观察结果帮助解决了这一问题,并导致了下一代体外充氧器:Kolff及其同事观察到血液在其第一个人造肾脏机器中穿过玻璃纸腔时被充氧。到1956年,Clowes 等人开发了一种独特的充氧器,该充氧器具有将气相和液相分开的膜,可以延长血液的体外循环时间。该设备最初在开放式心脏手术的新兴领域中用作“心肺旁路”。到1960年代,ECMO技术已被用于体外灌注,以支持患有心脏和呼吸衰竭的患者。1965年,Rashkind及其同事首次尝试在呼吸衰竭的新生儿中使用体外循环。十年后,Bartlett 等人。报道了在患有严重胎粪吸入综合征的新生儿中首次成功使用ECMO。作为这些努力的结果是,在难治性呼吸衰竭新生儿使用ECMO的大幅增加,从随机对照试验通过结果的支持确认在这些婴儿(ECMO与改善生存8 -10y)。自1989年成立体外生命支持组织(ELSO)注册表并开始收集有关体外生命支持使用和生存的数据以来,已有31,500多名新生儿接受了ECMO的呼吸衰竭治疗;其中,有87%的人在ECMO过程中幸存下来,而73%的人随后被出院或转移。成人 1972年,希尔等人报道了在新近描述的急性呼吸窘迫综合征(ARDS)的成年人中首次成功使用长期ECMO。两年后,美国国立卫生研究院(National Institutes of Health)启动了第一项ECMO与常规治疗成人ARDS的多中心随机临床试验(表1)。在90名试验参与者中,有42名接受了部分流性静脉动脉(VA)-ECMO。治疗组和对照组的两周死亡率相当(90%);ECMO没有生存优势。1994年,Morris 等人。发表了第二项随机试验,该试验通过将吸气和呼气时间与低流量静脉静脉(VV)-ECMO对比传统疗法的吸气和呼气时间成反比来评估机械通气。在40位参与者中,有21位接受了VV ECMO。对照组和VV-ECMO组之间随机分组后30天的生存率无显着差异(分别为42%和 33%)。鉴于这两项试验的令人沮丧的结果,在接下来的15年中,ECMO未被纳入ARDS的循证治疗算法中。但是,这些早期试验的结果可能与现代ARDS管理无关,因为随着时间的推移,ECMO的部署和技术以及对成人ARDS的常规治疗均发生了很大变化。VV(通向右心房的静脉腔)回路为低氧血症性呼吸衰竭提供了当前的ECMO支持,与最初的VA回路(由于体外循环实践引起的)相比,VV回路具有更低的创伤性和更好的耐受性。较新的充氧器可提供更有效的气体交换,并且当今的回路不太可能引起凝结,从而减少了对抗凝和血液制品的需求。这些进步使我们更加有效。如今,ECMO已成为治疗可逆性呼吸衰竭的多种原因的一种公认治疗方法,包括肺移植患者的原发性移植物功能障碍,并且是某些患者选择性肺移植的桥梁。ECMO的当前适应症以及绝对禁忌症和相对禁忌症如图1所示。ARDS和ECMO目前,ARDS被认为是许多(即使不是大多数)肺部损伤的最终常见途径,并且通常是成年人严重缺氧性呼吸衰竭的相关疾病。尽管进行了半个多世纪的研究,ARDS尚无特效药。ARDS治疗是辅助治疗,主要基于正压机械通气。ARDS是在重症监护病房在世界各地普遍存在,涉及高的成本负担,并有大量的死亡率有关。在1980年代和1990年代,即使研究人员正在探索ECMO在严重低氧血症性呼吸衰竭患者中的实用性,对正压机械通气的毒性作用的理解也在不断发展。发现机械通气潜在地伤害肺部,主要是由于过度扩张(volutrauma),高气道压力(barotrauma),甚至是扩张不足(atelectotrauma)。发现这种创伤会引起局部和全身性炎症,并使已经受损的肺泡气体交换恶化。从通风不良效果的总和被称为“呼吸机诱导性肺损伤”(VILI)。毫无疑问,支持ARDS的机械呼吸器的真正基础实际上是加剧了肺部损伤并导致了ARDS的高死亡率。因此,在20世纪90年代开始出现了新的技术辅助机械通气。具有里程碑意义的ARDSnet试验表明,与传统的潮气量相比,ARDS患者的潮气量为6 mL / kg预测体重和30 cmH 2 O 的平稳压力降低了ARDS患者的院内死亡率和通气天数。12 mL/ kg,平稳压力为50 cmH2O。然而,进一步的研究发现VILI的形态学和生理学证据,尽管这样的小潮气量(6毫升/ kg)和平台压(28-30CMH 2 O),这表明肺保护措施被保证。此外,在许多严重ARDS病例中,建议的呼吸机设置不允许充分的充氧或通气,从而迫使提供者使用最大的氧气浓度和较大的潮气量以及更高的气道压力来为患者充分充氧和通气。俯卧位,呼气末正压管理和肺复张操作的最新进展旨在改善氧合和减少肺外伤,并似乎增强了ARDS的总体生存结果;尽管如此,为减轻VILI的影响还需要做更多的改进。这些考虑促使人们重新开始将ECMO纳入ARDS治疗算法的兴趣。通过支持具有肺保护性机械通气的严重ARDS中的氧合作用和CO 2去除,ECMO可能获得VILI的最终保护。ECMO在ARDS的应用在2000年代后期,出现了两种不同的趋势,以促进在全球范围内增加ECMO用于呼吸衰竭的使用:(I)2009年全球猪源性甲型H1N1流感大流行,在此期间,许多以前健康的年轻患者出现了严重的呼吸衰竭; (II)VV-ECMO治疗呼吸衰竭的第一项主要随机对照试验[CESAR(常规呼吸机或严重成人呼吸衰竭的ECMO)试验,其中ECMO被证明具有有益作用。这项具有里程碑意义的试验为最近发表的EOLIA(严重急性呼吸窘迫综合征的体外膜氧合)试验奠定了基础。ECMO用于流感管理在H1N1大流行期间,ECMO用作严重ARDS和低氧血症性呼吸衰竭的抢救方法。报告的结果令人鼓舞。澳大利亚和新西兰的体外膜氧合流行性感冒调查员报告,在68例因难治性H1N1引起的ARDS接受ECMO的患者中,存活率为75%。值得注意的是,这些患者在ECMO插管时患有严重的ARDS:动脉血氧分压(PaO 2)与吸入氧分压(FiO 2)的比值为18 cmH 2,中位值为56 mmHgO为呼气末正压要求,Murray评分为3.8。在来自英国的一项倾向匹配研究中,转移到ECMO中心的H1N1患者的医院死亡率是未参考ECMO的患者的一半。CESAR实验在英国的多中心CESAR试验中,重度ARDS患者按1:1随机接受ECMO或标准治疗(表1)。在5年内(2001年7月至2006年8月)从68个中心招募了总共180名患者(每组90名)。ECMO患者被转移到一个中心,而传统护理患者仍留在他们的基层医院。纳入标准为Murray得分≥3,无代偿性高碳酸血症和18-65岁。排除标准为:≥7天的峰值气道压力> 30 cmH 2 O或FiO 2 > 0.8,颅内出血迹象或全身性抗凝的任何禁忌症。大约三分之二的参与者,肺炎是ARDS的根本原因。平均基线PaO2 / FiO 2比在对照组中为75 mmHg,在ECMO组中为76 mmHg。主要终点是随机分配后6个月内的死亡或严重残疾。ECMO组的生存率明显优于常规治疗组(分别为63%和 47%);相对风险为0.69 [95%置信区间(CI),0.05-0.97;P = 0.03],需要治疗的人数为7名患者。降低主要结局的绝对风险为16%,需要治疗的人数为6名患者(图2)。但是,干预组中有24%(22/90)的患者从未接受过ECMO:5例在转移前或转移过程中死亡,在仅接受常规通气的17例患者中,有82%(14/17)的患者无需ECMO即可生存。试验设计没有为对照组规定特定的肺保护通气策略。结果,只有70%的对照患者采用了肺保护策略,而ECMO组为93%。两组均采用俯卧定位(常规医疗管理组为 42%,ECMO组为 36%;P = 0.58)。尽管有其局限性,CESAR试验显示出将潜在可逆性呼吸衰竭患者转移到专门从事ARDS管理的中心的重要性。该试验还支持肺保护通气和VV-ECMO作为重度ARDS的有效治疗方法,从而导致ECMO在临床实践和进一步ECMO研究中的广泛使用。但是,由于ECMO怀疑论者可能会质疑ECMO部门的患者是从ECMO还是从高级医疗管理中获益更多,因此有必要进行进一步的调查以试图回答该问题,因此进行了EOLIA试验。EOLIA试验是一项针对重度ARDS成人的多中心,国际,前瞻性随机试验,将早期VV-ECMO与标准肺保护通气进行了比较(表1)。该试验旨在通过严格的机械通气控制,运输前的ECMO启动以及对照组中对机械通气方案的更好依从性来弥补CESAR试验的方法学局限性。纳入标准为严重的低氧血症,PaO 2 / FiO 2比率<50 mmHg持续> 3小时,或<80 mmHg持续> 6小时,或pH <7.25,动脉CO 2分压≥60 mmHg持续6小时以上。患有顽固性低氧血症(定义为氧饱和度<80%至少6小时)且无不可逆的多器官功能衰竭的对照组患者可转用ECMO。主要终点是60天死亡率。随机分组时,该高危人群的平均PaO 2 / FiO 2比为73 mmHg,平均连续器官功能衰竭评估得分为10.7。59%的人以前使用过俯卧位,94%的人进行了神经肌肉阻滞,53%的人使用了吸入一氧化氮或前列环素。ECMO组的60天死亡率绝对降低了11%(35%比 46%,P = 0.07),相对危险度降低了0.76(95%CI,0.55-1.04;P = 0.09)。相比之下,越过接受紧急ECMO的对照组患者中28%(35/125)的60天死亡率为57%。最初的ECMO组在插管后约34小时和随机分组后3小时开始ECMO,而抢救型ECMO组则在后来(随机分组后6.5±9.7天,即原始组开始ECMO后约5天。这些结果表明,与早期ECMO相比,ECMO具有优势。次要分析显示,治疗失败的相对风险(定义为ECMO组在第60天死亡,并且转换为ECMO或对照组死亡)为0.62(95%CI,0.47-0.82;P <0.001),且ECMO组的治疗失败率为35%,对照组为58%。ECMO支持持续了15±13天。传统上,ECMO与不良事件的高发生率相关。但是,在EOLIA试验中,ECMO组的中风发生率实际上较低(2%对 6%)。尽管ECMO组的大量输血(2%比 1%)和严重的血小板减少症(27%vs.16%),考虑到潜在的呼吸系统疾病的严重程度,这些比例并没有过高。值得注意的是,靶向抗凝水平是激活的部分凝血活酶时间为40-55秒,低于其他中心通常使用的60-80秒。此外,在对次要结果的意向性治疗分析中,ECMO组的机械通气时间减少了20天,血管加压药需求减少了9天,肾脏替代治疗减少了18天。这些数据表明,ECMO以某种方式减少了循环系统和肾脏功能障碍,甚至可以预防多器官功能障碍综合征。此外,在ECMO期间,潮气量减少了43%,呼吸频率减少了23%,而呼气末正压保持不变。经常被引用的,可能是EOLIA试验的缺点是,其功效计算是基于ECMO相对于传统医学管理的预期20%生存优势。对于ARDS的任何支持性干预,这可能是不切实际的期望。在试验的设计中,未能实现这一降低的目的被认为是徒劳的;因此,如果计划入组计划的队列中的75%(249/331)后,预计死亡率不会降低20%,则按照方案,应尽早停止试验招募。这项研究的不足被认为是ECMO与对照组之间的死亡率差异未达到统计学显着性的原因(P = 0.07)。实际上,将需要624名患者有足够的力量来检测ECMO患者的死亡率降低11%(非ECMO患者的死亡率降低46%)。鉴于EOLIA的注册率,完成该试验将花费9年的时间。其他固有的因素使EOLIA另一个结论不可行。首先,在非ECMO对照组中禁止患者使用交叉ECMO是不道德的。尽管如此,寻找特征性重度ARDS中非ECMO恢复的预测指标可能具有一定的价值,以便确定不需要ECMO的患者以及处于常规(非ECMO)治疗失败风险中并应开始的患者。ECMO早于而不是晚。未来的研究可能会调查ARDS严重程度较低(PaO2/FiO2比例为75-125 mmHg),早期的ECMO可以提高生存率并减少对通气支持,血管活性药物和肾脏替代的依赖。此外,如果降低抗凝水平是可行的,那么可以降低ECMO的一些固有风险,从而使风险收益比偏向于早期的ECMO。其次,由于1015名合格患者中只有249名(24.5%)被纳入,因此EOLIA试验的招募十分困难。实际上,由于已经开始ECMO,因此筛除了EOLIA的患者中有23%被淘汰,这可能反映了临床医生对该手术的广泛接受。ECMO在治疗呼吸衰竭和重度ARDS中起着重要作用。现在的研究对何时启动ECMO有争议。死亡率风险模型随着VV-ECMO逐渐发展为重度ARDS患者的治疗选择,其使用正在增加。在2019年1月的ELSO注册报告中,使用VV-ECMO的成年人中有59%幸免于难。但是,对于临床医生来说,确定ECMO的最佳候选人仍然具有挑战性。当几位临床医生讨论同一位患者时,使用死亡风险评分可客观评估该患者的生存前景。此外,确定可能无效的患者可以减少不必要的资源利用,并有助于为家庭成员提供更现实的预后。有几种可预测的死亡风险模型可帮助临床医生确定最有可能存活的患者。这些包括在H1N1流行期间开发的ECMOnet评分在VV-ECMO上为SEVERE ARDS预测P死亡的死亡风险评分和根据ELSO注册中心开发的RESP(呼吸体外膜氧合生存预测)评分(表2)。根据我们的经验,RESP评分具有便捷的在线计算器,并且似乎在这些模型中得到最充分的验证,可提供临床实用性。神经系统并发症VV-ECMO的神经系统并发症包括癫痫发作,缺血性中风,颅内出血和脑死亡;这些都可能增加发病率和死亡率。Lorusso 等人使用1992年至2015年的ELSO注册数据。报告说,神经系统损伤的总发生率为7.1%,包括颅内出血(42.5%),脑死亡(23.5%),缺血性中风(19.9%)和癫痫发作(14.1%)。ECMO发作前的心脏骤停,持续的静脉血液滤过以及严重的高胆红素血症与高EMO有关。神经系统并发症的风险。脑损伤的机制包括ECMO缺氧前损伤,栓塞,再灌注损伤和凝血异常。除非患者有未诊断的心内分流,否则将ECMO插管放置在静脉系统而不是静脉动脉系统中时,可以降低回路发生栓塞性中风的风险。尽管如此,在过去的二十年中,神经损伤的发生率有所下降,这可能是由于更好的患者选择,改进的技术,一致的监测,增加的临床医生经验以及减少抗凝治疗的结果。这与EOLIA试验的结果一致,该结果显示ECMO组中风的发生率较低。出血/血栓形成出血是VV-ECMO患者最常见的并发症之一,在对18项研究和646例患者的系统评价中,约有16%的病例发生出血。由于血液与ECMO回路之间的相互作用而引起的全身性抗凝和凝血病增加了出血风险。2019年ELSO注册机构国际报告指出,2014年至2019年1月接受ECMO的成年人中有7.8%的患者出现套管出血,其中6.8%的手术出血,3.9%的肺出血和2.5%的脑出血。输血也与死亡风险增加相关。此外,以上引用的系统评价发现有53%的患者发生了血栓形成,尽管并非所有研究结果都具有临床意义。这表明需要平衡每个患者的出血和血栓形成风险。结论在几十年的时间里,因低氧血症性呼吸衰竭而接受ECMO治疗的患者的生存率已从1970年代的10%增长到如今的约60%。在过去的五十年中,体外技术变得更加安全和有效。此外,由于ECMO在H1N1大流行和CESAR试验中取得了成功,因此在过去10年中,用于低氧血症性呼吸衰竭的使用已大大增加。尽管尚未完全确定ECMO在ARDS中的确切作用和最佳时机,甚至尚未确定其对ARDS病理生理的影响,但最近发表的EOLIA试验表明,应扩大ECMO在ARDS的治疗中的应用(当然还有严重的ARDS)中的作用,产生明显更好的临床效果。
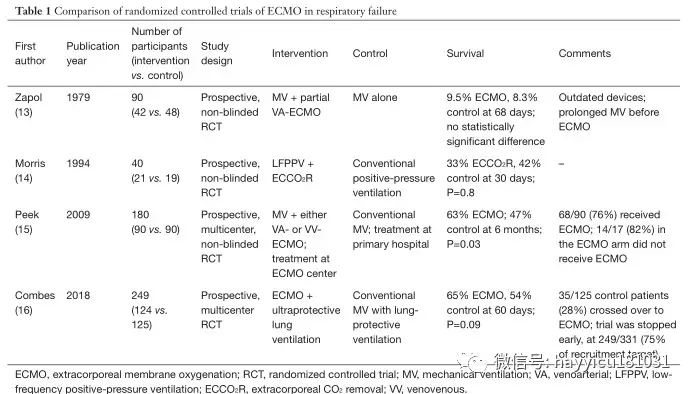

Figure 1 Indications and contraindications to the use of ECMO in respiratory failure. ECMO, extracorporeal membrane oxygenation;PEEP, positive end-expiratory pressure; FiO 2 , fraction of inspired oxygen; ARDS, acute respiratory distress syndrome; INR, international normalized ratio (prothrombin time); LFT, liver function test; CRRT, continuous renal replacement therapy; RESP, Respiratory Extracorporeal Membrane Oxygenation Survival Prediction score; PRESERVE, PRedicting dEath for SEvere ARDS on VV-ECMO score.Fig2 Kaplan-Meier survival estimates from the CESAR trial (Lancet 2009:374:1351-63 with permission). *, patients were randomly allocated to consideration for treatment by ECMO but did not necessarily receive this treatment. CESAR, Conventional ventilation or ECMO for Severe Adult Respiratory failure; ECMO, extracorporeal membrane oxygenation.
---J Thorac Dis. 2019 Sep;11(Suppl 14):S1688-S1697. doi: 10.21037/jtd.2019.05.73