成人急性呼吸衰竭患者V-V ECMO后插管源性静脉血栓形成的发生率及危险因素
转自 体外生命支持分会ChELSA
第六十期
请输入标题 abcdefg
2
成人急性呼吸衰竭患者V-V ECMO后插管源性静脉血栓形成的发生率及危险因素
Incidence and Risk Factors for Cannula-Related Venous Thrombosis After Venovenous Extracorporeal Membrane Oxygenation in Adult Patients With Acute Respiratory Failure
Fisser C, et al. Crit Care Med. 2019 Apr;47(4):e332-e339.

文
献
回
顾
研究背景
1971年,ECMO首次用于1例急性创伤后呼吸功能不全的成年患者。CESAR试验对比传统呼吸支持和ECMO对成人严重呼衰治疗效果,已经证实ECMO的应用可显著改善急性呼吸窘迫综合征(ARDS)的生存率。然而,ECMO治疗依然受到出血和血栓形成等并发症的影响。无论抗凝效果如何,ICU病人静脉血栓形成的发生风险显著增高,静脉血栓栓塞症(VTE)受到广泛关注。
VTE发生的主要原因是中心静脉导管、血流不畅以及合并症,而VTE对于所有院内死亡的病因而言,是最可能被预防的。尤其在ICU中,肺栓塞(PE)时常被漏诊。
由于考虑到血栓形成的重要性和潜在不良后果,对于ECMO后血栓形成的发生率知之甚少。
研究目的
本研究通过超声检查法和CT评估V-V ECMO撤机后导管相关的静脉血栓形成的发生率和危险因素。
研究方法
1. 回顾性分析2010年10月-2017年2月之间所有在雷根斯堡大学医院ICU接受V-V ECMO(>2.5 L/min)治疗并成功撤机的成年严重呼衰患者(PaO2/FiO2<85mmHg和/或呼吸性酸中毒pH<7.25)。排除ECMO治疗失败的死亡病例或未进行导管相关血栓形成筛查的病例(见图1)。

2. 对人口统计资料、插管情况(部位、尺寸、单/双腔)、ECMO天数、ICU内存活率、实验室检查(aPTT、D-二聚体、INR、纤维蛋白原、抗凝血酶、游离血红蛋白、血小板)等数据进行分析。
3. ECMO安置和抗凝:
所采用的插管技术为从股静脉流出,颈内静脉流入,可根据患者的独特解剖结构进行调整。根据解剖原因或者当病人状态选择单腔(Maquet-Getinge, Rastatt, Germany)和双腔导管(Avalon-Elite, Maquet-Getinge; 和Twin-Port, NovaPort-twin, Novalung, Heilbronn, Germany; 和ParaGlide Dual-Lymen, Chalice Medical, Nottinghamshire, United Kingdom)。在超声引导下应用Seldinger技术置管,置管后通过超声和X线确认部位正确。根据目前的指南推荐,将ECMO的目标aPTT设定在50±5s。氧合器类型的选择(Cardiohelp 5.0, 7.0, IR, ELS, PALP, PLS; Quadrox-iD Ped, Maquet, Germany 和 Hilite LT7000, ILA active; Novalung, Heilbronn, Germany and ECC.O5; Sorin, Italy)由可获得性和患者的特异性需求决定。如果发现氧输送不足、膜肺内压力增高或ECMO导致的凝血紊乱,则更换氧合器。
4. ECMO撤机和拔管:
当潜在性疾病得到控制后,一步步撤除ECMO。根据成功的撤机试验计划(ECMO血流量1.5L/min以及停机至少30分钟)拔管。在通过手动挤压、缝合皮肤及皮下组织控制出血后,将可充气气囊带系统(SafeGuard; MeritEMEA,Limburg,The Netherlands)贴附插管部位24小时。
5. 血栓栓塞事件的诊断:
在拔管后的3天之内,进行超声检查,评估静脉不可压缩性、无血流以及血栓出现。检查颈静脉直到锁骨下静脉汇入处,股静脉检查由腘静脉到髂总静脉。将把管腔堵塞超过50%的血栓归类为大血栓形成,因为血栓越大,其扩大的风险越高,肺栓塞的危险性越大。不仅如此,所有可用于住院期间PE和血栓形成分析的CT扫描均被采用。PE仅用CT扫描而未用其他成像模式检查。弥散性血管内凝血(DIC):根据国际血栓和出血协会的指南计算基线DIC评分。
6. 统计分析
所有定量数据均以均数±标准差或均数±四分位数间距表示,并根据血栓形成分层。方差齐的连续和正态分布的变量应用t检验,方差不齐的应用W检验进行假设检验。非正态资料应用U检验。正态变量组间的差异应用卡方检验比较。如果样本量小于五,则用费舍尔检验。通过受试者工作特征(ROC)分析和体外生命支持组织(ELSO)的建议,确定单因素逻辑回归的截止点。单因素逻辑回归模型旨在分析实验室检查价值和基线血栓形成的相关性。将单因素回归中P值小于0.1的因素和年龄、性别、体质指数纳入多因素逻辑回归模型,序惯性器官衰竭评分(SOFA)同时进行。所有的P值都为双侧,P值小于等于0.05被认为有统计学意义。应用Microsoft EXCEL365 ProPlus (Microsoft, Redmond, WA) 和SPSS 23.0 (IBM, Armonk, NY)软件进行统计分析。
研究结果
1. 人群和导管相关血栓形成的发生率:
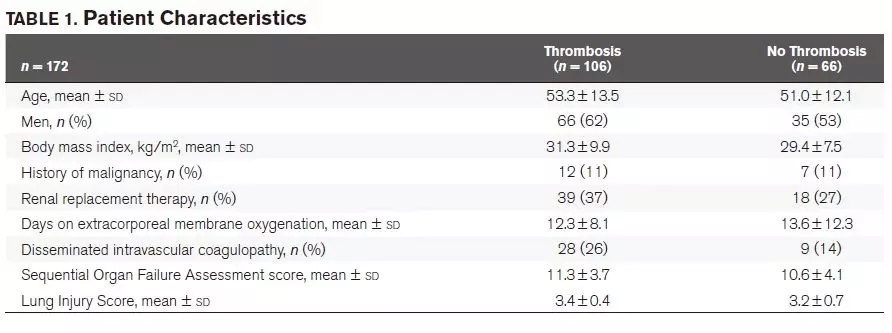
研究队列主要由多种评分提示为重症的和曾患ARDS(76%)的男性(59%)构成(见表1)。197名患者从ECMO成功撤机,其中172名患者的插管部位经过超声检查。
血栓形成的发生率为62%(106/172)。静脉管腔狭窄超过50%的患者占28%(48/172)。血栓形成出现于颈静脉的占82%(87/106),股静脉内的占33%(35/106),两者都出现的占15%(16/106)。大血栓在颈静脉和股静脉内的分布没有差异(P=0.689)。
2. 人口统计学风险因素:
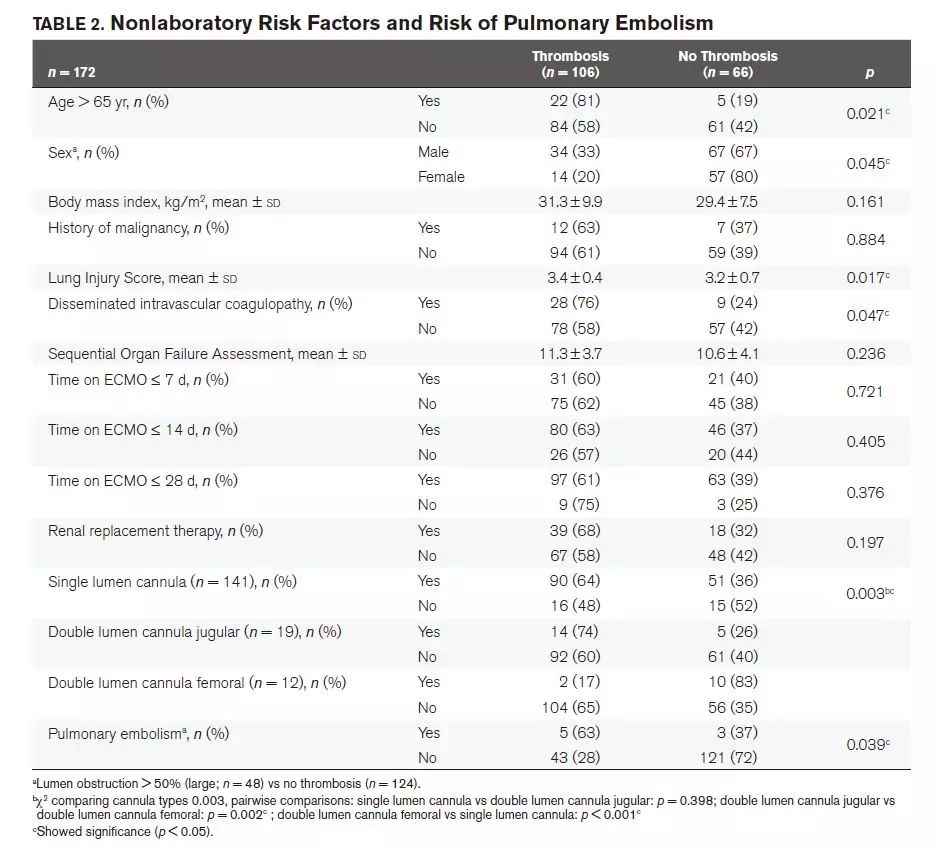
男性、年龄大于65岁和有DIC的患者的血栓形成发生率更高。较高的DIC评分与血栓形成风险增加相关。未发现血栓形成的发生率与ECMO时间、肾脏替代治疗、恶性病史之间的相关性(见表2)。
3. 肺栓塞发生率:
9%(16/172)的超声扫描患者在ECMO开始时被CT诊断为PE。在ECMO期间的增强CT扫描发现了另外8名PE患者(5%),其中7名(88%)患者在拔管后被诊断出血栓形成。出现大血栓的患者发生PE的风险显著高于其他患者(P=0.039)。血栓部位的高低对PE发生率则无统计学意义(P=0.144),而无论血栓部位高低,该类患者的PE发生率显著增高(P=0.010)。
4. 插管和氧合器的尺寸和型号:
无论流入管还是流出管,均未发现血栓和导管尺寸之间的关系。股静脉的NovaPort twin导管(Novalung, Heilbronn, Germany)的血栓形成风险较低(P<0.001)(见表2)。血栓形成的速率与每位患者氧合器气体交换次数或氧合器的类型无关。
5. 实验室检查:
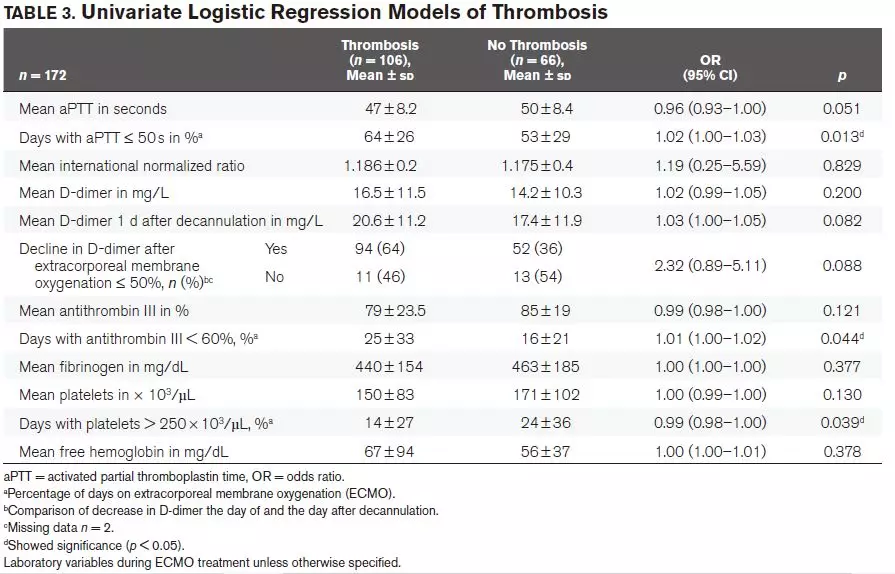
平均aPTT与血栓的进展有关(P=0.051),aPTT时间≤50s的患者血栓形成速度增加(P=0.013)。此外,出现大血栓的患者其aPTT时间≤50s的天数显著多于未出现大血栓的患者(P=0.049)。INR均值、抗凝血酶III、纤维蛋白原、血小板、游离血红蛋白对血栓形成的速率无影响。在ECMO治疗期间,平均抗凝血酶水平低于正常值60%的天数比例较高的患者血栓形成率较高(见表3)。有血栓的患者其D-二聚体的绝对值较高。与先前的ECMO的值相比,拔管后第二天D-二聚体下降小于等于50%的患者,其血栓形成的风险往往更高。
6. 血栓形成的危险因素——多因素逻辑回归模型:
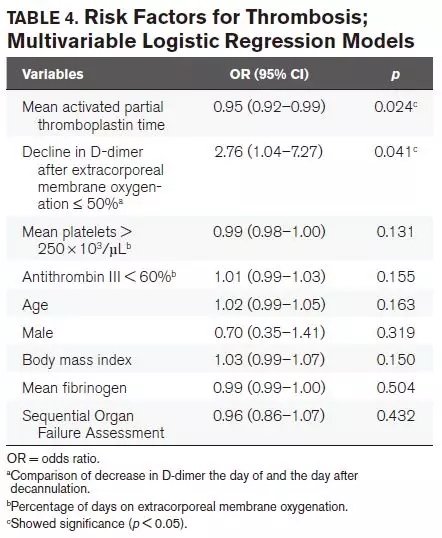
将平均aPTT时间、撤机后D-二聚体下降到小于等于50%、血小板高于250×103 uL、纤维蛋白原、抗凝血酶III水平低于60%、年龄、性别、BMI、SOFA评分作为预测因素纳入多因素逻辑回归模型,发现平均aPTT时间和D-二聚体下降小于等于50%是血栓形成的独立危险因素(见表4)。
研究讨论
本研究是截至目前评估V-V ECMO后的成年患者发生插管相关血栓形成的规模最大的研究。本研究为V-V ECMO后血栓形成发生率提供新的见解,并且分析血栓形成进展的潜在危险因素。本研究的主要发现是:1. 插管部位血栓形成的发生率为62%,导致管腔阻塞超过50%的大血栓的发生率为28%。2. ECMO过程中平均aPTT时间小于等于50s的患者血栓形成的风险更高。3. 在调整风险因素后,拔管后第二天D-二聚体下降小于等于50%与较高的血栓形成率相关。
在本研究中,87%的患者进行插管相关血栓形成的筛查,静脉血栓发生率为62%,ECMO后大血栓形成发生率为28%。其他中心报道的ECMO后大血栓形成的发生率为0-85%,范围如此巨大的原因可能是患者、导管选择或检查方法的不同。关于插管相关血栓的另一个研究中发现,血栓形成发生率为18%。其比例较低的原因可能是大多数患者是经股静脉插管,因而其诊断率较低。
本研究团队认为,血栓事件应该因为并发症发生率不同而被归类为大血栓和非大血栓。然而,目前并没有一个被认可的分级系统。为了避免不确定性,根据静脉管腔梗阻超过50%来区分血栓事件的发生。在大血栓形成的亚组中,PE的发生率较高。因此,这种简单的鉴别可能有助于识别PE风险较高的患者。此外,如果两个插管的静脉中都存在血栓形成,则PE的发生率更高。
血栓栓塞的危险因素可分为可改善和不可改善两类,其中包括年龄和性别,正如本研究所证实。此外,血栓形成患者的肺损伤值较高、DIC评分较高,这又导致其血栓形成的风险增加。因此,应该对DIC评分大于或等于4与血栓形成的关系进行进一步研究。我们的研究证实了DIC与血栓形成的进展有关,但也会导致更多的出血事件。因此,改良的抗凝方案基于患者的个体特征。其他的可改善的危险因素有ECMO时长、导管类型以及膜式氧合器。
本研究发现,在19名置入颈静脉双腔管的患者中有14名出现血栓形成,在10名置入股静脉双腔管的患者中有2名出现血栓形成。此外,未发现单腔管与血栓的大小及发生率之间的关系。尽管股静脉置管中血栓的发生率较低,但不清楚这些患者髂静脉或腔静脉内血栓的发生率是否会升高。因此,插管的选择可能更应根据患者的具体需求和解剖,而不是根据不同静脉内血栓形成的可能风险。
在某些情况下,膜式氧合器的效率会随着时间的推移而降低。氧合器内的进行性的血栓形成被认为是氧合器功能障碍的可能原因。因此,氧合器流量的变化可能是血栓形成的间接征象。然而,我们未能发现到血栓形成与氧合器流量变化或氧合器类型之间的任何相关性。
有效的抗凝治疗可以防止血栓形成,但目前尚无普遍接受的标准可用于接受V-V ECMO的患者。根据ELSO指南,大多数中心倾向于将aPTT水平增加1.5-2倍,但其他中心则考虑出血风险而提倡预防性抗凝。研究人员未发现抗凝水平与血栓形成之间的关系,但Trudzinski等的研究中发现,aPTT水平较低的患者其血栓形成风险更大,这与本研究结果类似。在ECMO期间,平均aPTT水平小于或等于50s导致血栓形成的风险增加,对于大血栓形成甚至更明显。在调整多种风险因素后,aPTT水平仍然是血栓形成的独立危险因素。其他凝血变量如INR,抗凝血酶III,纤维蛋白原和血小板与血栓形成的发生率无关。
D-二聚体起源于纤维蛋白网分解期间,D-二聚体检查阴性是排除血栓栓塞的高度可靠的标志。一些专家认为D-二聚体的数量可作为血栓栓塞患者治疗性抗凝持续时间的指导。D-二聚体还可以根据凝血情况预测是否需要更换模式氧合器。在本研究中,当调整风险因素后,拔管后第二天D-二聚体下降小于或等于50%与导管相关血栓形成发生率较高呈独立相关。因此,拔管后D-二聚体下降的程度可预测血栓形成。这种易于获得的变量可以帮助识别拔管后需要持续抗凝的患者,直到可以通过进一步的诊断排除血栓形成的存在。
局限性:拔管后在插管区域内进行常规超声检查,但由于解剖学原因,髂静脉和腔静脉通常难以评估。因此,可能漏诊一些临床上难以察觉的血栓形成事件。回顾性的设计、分析仅限于ECMO幸存者、严重出血的情况下很少使用促凝因子都可能对研究结果造成偏倚。因此,血栓形成的总体发病率可能不同。拔管后未进行系统性超声评估。没有关于长期随访的数据。
研究结论
V-V ECMO后插管相关血栓形成的发生率很高。弱化的全身抗凝可能增加血栓形成的风险。拔管后D-二聚体持续升高可能提示血栓形成。应对ECMO后患者常规进行超声检查,从而检测插管静脉内血栓形成情况。

本期文献回顾:张沛瑶
中国医学科学院阜外医院