体外膜肺氧合支持的成年患者中出血事件相关的预测因素
来源:中南大学湘雅医院重症医学科

李萧 彭米林 翻译 张丽娜 校对
摘要
研究背景:
在接受体外膜肺氧合支持(ECMO)支持的危重症患者中,出血是最常见的并发症。然而,在ECMO支持期间,尤其是在伴有凝血功能异常和抗凝治疗的患者中,目前出血的危险因素尚未阐明。本研究目的是探讨ECMO支持的重症患者出血并发症的发生率以及明确出血相关的危险因素。
方法:我们回顾性分析了2010年至2013年内2个参与的ICU中接受静脉-静脉(VV)或静脉-动脉(VA) ECMO支持的成年患者。根据体外生命支持组织(ELSO)的定义,比较有无出血并发症的患者特点,通过生存分析评估出血并发症对患者结局的影响。模型纳入了出血独立相关的变量,包括ECMO支持期间每日临床和生化变量。
结果:147例成年患者接受了149次ECMO支持治疗(111 VA-ECMO和38 VV-ECMO),89次(60%)由于至少一次的出血事件致病情复杂。最常发生出血的部位有:ECMO置管处(37%)、血胸或心脏填塞(17%)及耳鼻和喉(16%)。5例患者(2.2%)出现颅内出血。出血并发症与生存预后差独立相关[调整后风险比 (HR) 2.17, 95 % 可信区间 (CI) 1.07–4.41, P=0.03]。高活化部分凝血活酶时间(aPTT) [调整比值比(OR) 3.00, 95% CI 1.64–5.47, P<0.01]、APACHE II评分(调整OR 1.01, 95% CI 1.01–1.02, P=0.01)、及手术后予以ECMO (调整OR 3.04, 95% CI 1.62–5.69, P<0.01)与发生出血的较高风险独立相关。当单独分析非手术后VA-ECMO患者时,同样的也发现出血与高aPTT独立相关。
结论:基于ELSO定义的出血事件发生率在ECMO期间超过60%,且与住院死亡率相关。我们发现出血前高aPTT值是出血的独立危险因素,提示控制好患者的aPTT(通过更好的控制凝血或抗凝)可能会改善患者预后。
关键词:体外膜肺氧合;重症患者;失血;出血;抗凝;凝血;血栓
研究背景
在接受体外膜肺氧合支持(ECMO)支持的重症患者中,出血是最常见的并发症之一,发生在约30%的ECMO支持患者。出血事件独立影响患者的预后(包括死亡率)。这种关联可能可以通过出血部位来解释,在H1N1流感爆发期间接受ECMO治疗的患者中超过40%的非幸存者发现了颅内出血(ICH)。
已有明确很多可能使接受ECMO患者出血风险高的因素,这些因素可以归结为患者自身因素、治疗因素和循环相关因素。全身炎症反应综合征(SIRS)和患者血液与ECMO循环之间的接触导致激活凝血级联反应,从而对纤维蛋白溶解、血栓形成和血小板功能产生影响。由于血栓形成和出血的风险共存,可能难以预测凝血平衡变化所导致的结果。尽管使用生物素表面 - 肝素化体外灌注回路可降低血栓形成的风险,减少炎症,凝血激活和血小板消耗,但抗凝治疗仍然是接受ECMO患者避免出现回路相关血栓形成风险的标准做法。实际上,血栓形成事件可能使ECMO治疗复杂化并显著增加ECMO的发病率和死亡率。约15%的患者在ECMO期间确定血栓形成事件,但还很可能存在认知不足及未报道。
在ECMO期间更好地了解出血特点对于改善接受ECMO患者的管理和结局至关重要。过去几十年中,关于体内出血的危险因素研究只局限于儿科或存在一些局限性,包括对出血没有标准的界定,及ECMO循环和护理研究进展的掌握。
因此,我们的目的是研究接受ECMO支持的重症患者的出血并发症,探讨其发病率,对患者预后的影响及与出血风险增加相关的因素。
方法
试验设计
我们在两个中心进行了一项回顾性研究,即阿尔弗雷德医院(澳大利亚墨尔本)和贝桑松医院(法国)。阿尔弗雷德医院是蒙纳士大学附属的一所教学医院,为维多利亚州,南澳大利亚州和塔斯马尼亚州提供心脏和肺部移植服务。它拥有一个45床位的重症监护室(ICU),是维多利亚州成人创伤和ECMO的转诊中心。贝桑松医院是弗朗什-孔泰大学附属的教学医院;其21床医疗ICU在ECMO支持方面拥有长期经验。
2010年1月至2013年6月期间在阿尔弗雷德医院以及2013年1月至2013年12月期间入住贝桑松医院且接受ECMO治疗的所有成人入住ICU。
该研究得到了阿尔弗雷德健康人类研究伦理委员会(202/11)和贝桑松医院伦理委员会的批准。
ECMO凝血方案
两家医院对于ECMO患者有相同的凝血策略和指南,并且VV-和VA-ECMO之间凝血策略也大致相似。所有中心的标准抗凝方案为采用肝素抗凝,维持aPTT在50至70s之间,除非患者出血或出血风险增加(通常与围术期和创伤相关)。输注红细胞(RBC)以维持血红蛋白(Hb)大于8g/dL。除非患者有严重的血小板减少症(血小板计数<50,000/mm3),否者不会预防凝血障碍而输注血制品。当患者血小板计数低于80000/mm3时输注血小板;输注新鲜冰冻血浆(FFP)以维持国际标准化比值(INR)≤1.5 或凝血酶原(PT)> 70%;当血浆纤维蛋白原浓度低于1.5g/L时输注冷沉淀或纤维蛋白原。凝血因子复合物、抗纤溶药(氨甲环酸)、抗凝血酶Ⅲ和鱼精蛋白只有在患者的主治医师同意时才会输注。尽管肝素是抗凝治疗的首选,但是如果临床有必要也会使用华法林或来匹卢定抗凝治疗。ECMO回路中予以磷酸胆碱和肝素混合使用。在澳洲医院的规定中,根据氧合器循环中或结点上或者两个部位均出现了氧合器功能降低和氧合器转换压升高的情况提示可能有系统性纤溶发生,则会及时更换循环膜肺。ECMO患者会常规使用质子泵抑制剂。在澳洲医院VV-和VA-ECMO置管均是床旁经皮置入,而法国医院是在手术下完成。
临床和生化数据
回顾性地收集了入组患者的病史和临床资料,包括人口统计学资料、并发症、出入院时的资料、出入ICU时的资料、诊断和APACHEIII评分。并记录了药物抗凝治疗(如阿司匹林、氯吡格雷或维生素K拮抗剂),ECMO前的手术或心肺复苏记录,ECMO前和第3天的SOFA评分,ECMO期间有无肾脏替代治疗(RRT)、有无机械通气(MV)、有无主动脉球囊反搏治疗。还记录了ECMO期间每日最高和最低的生化指标(包括全血的Hb、血细胞计数、aPTT、INR、PT和纤维蛋白原水平)、最低体温、动脉血pH的最低值、动脉血游离钙、D-二聚体的最高值、尿素氮、胆红素及游离血红蛋白。
ECMO数据
ECMO数据包括开始和停止日期,ECMO是否在另一家医院启动,ECMO的主要适应症和ECMO的类型[静脉 - 静脉(VV)或静脉 - 动脉(VA),包括中心和外周VA ECMO]。还记录了以下数据:ECMO的结局,ICU的状况和出院时间以及出院后的去向。
出血事件和血栓的事件
在ECMO期间收集每日血制品和凝血药物的使用情况,包括抗凝血药物的种类和剂量。
我们根据ELSO的定义以确定出血:若病历或护理病历中记录有临床明显的出血,并且24小时内输注2个及以上单位的RBC或24小时内Hb下降2g/L以上;或者出现血胸、中枢神经系统或腹膜后出血;或者发生需要干预的出血。若如果连续几天出现与之前相同的主要出血灶,也认为是出血。并且会记录某位患者1天内全身出现多个出血灶的情况。
从病历中提取血栓栓塞并发症的相关资料,包括深静脉血栓形成,缺血性卒中,心内血栓,肺栓塞和需要更换膜肺的膜肺循环内凝血。
统计学分析
使用Stata 12.0软件进行统计分析。计数型变量根据数据分布类型用均数(标准差)或中位数(四分位数间距)表示。患者水平数据的假设检验分类变量用卡方检验,正态分布变量用t检验,非正态分布变量用秩和检验。为了比较有无出血事件发生的ECMO天数,并计算每位患者的重复出血次数(即在ECMO期间每日记录出血次数),对连续变量和二项式变量的随机效应逻辑模型进行重复测量混合模型。平均值和95%置信区间(CI)会根据重复测量次数进行调整。
使用Kaplan-Meier方法绘制生存曲线,组间比较使用对数秩检验。使用Cox比例风险回归模型进行评估预后的多因素分析,纳入结果相关的变量(P<0.2)。由于出血和存活之间是时间依赖性关系(在ECMO期间的不同时间发生出血),所以出血这一变量在Cox模型中作为时间协变量去分析。使用比例风险假设检验评估最终模型的比例。
使用多因素logistic回归分析模型研究出血的危险因素。首先,使用逐步后退法的模型,其仅纳入在出血发生之前记录的变量(例如,在出血事件之前1天的最高aPTT,出血事件之前1天的抗凝血治疗等)。aPTT在多因素分析中归为四分位数。为了计算每位患者的多次出血次数,在之前模型中与出血事件独立相关的变量纳入多级的logistic回归模型中,并且每位患者被建模为1个随机效应。在非术后VA-ECMO患者中进行亚组分析。
结果
研究期间,在两家医院(Alfred,n=125和Besançon,n=24)进行了149次ECMO支持,38 VV和111 VA ECMO。对于VV ECMO,支持的中位持续时间是8天(第一和第三四分位数:5-14),对于VA ECMO,支持的中位持续时间是6天(第一和第三四分位数:4-10)。表1为研究队列的特征。
表1:ECMO支持中比较有无出血事件
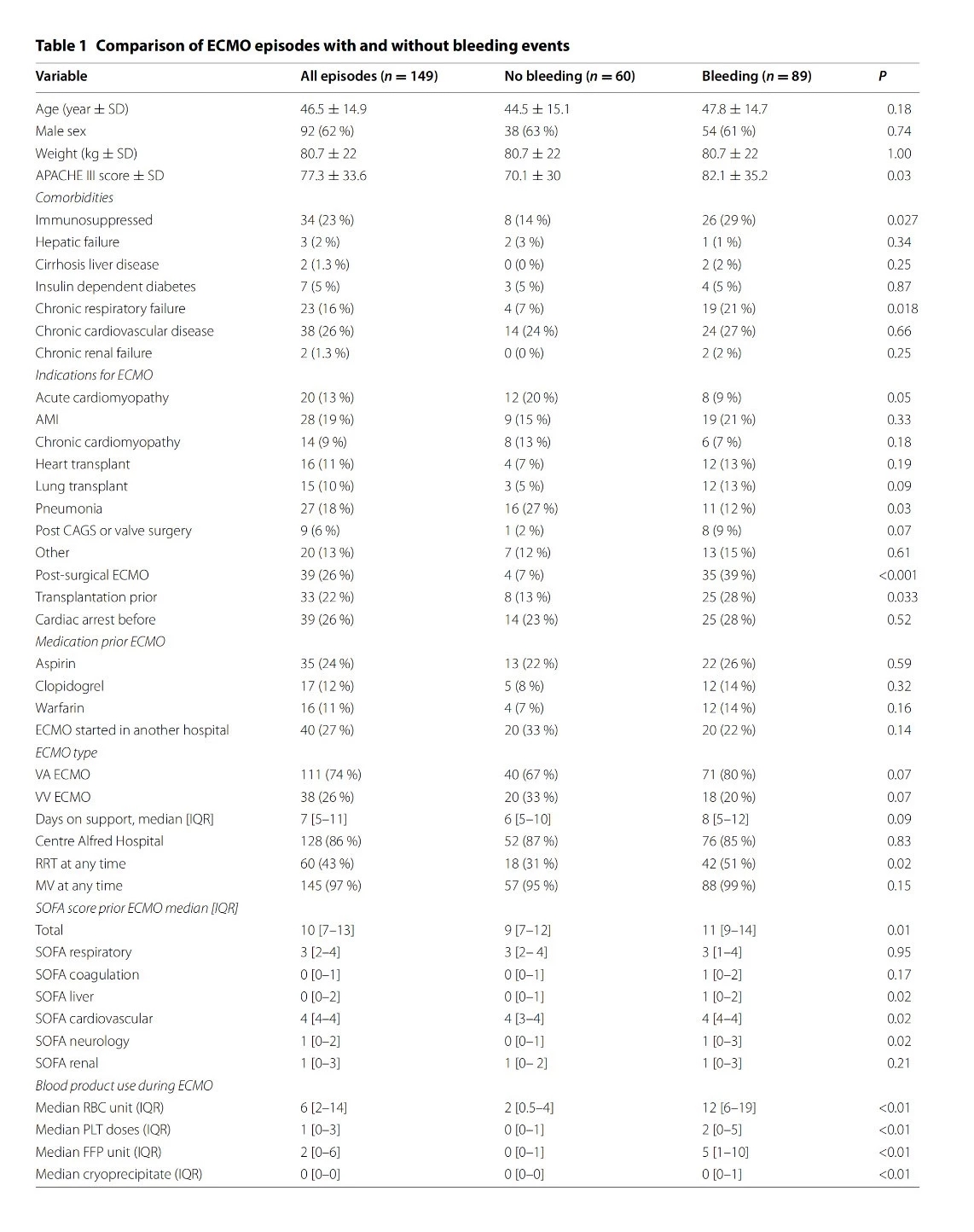
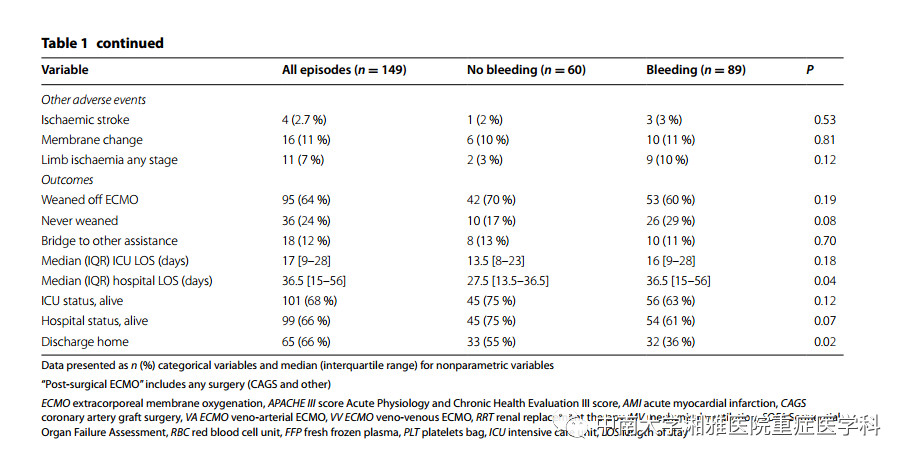
表注:正态分布变量用n(%)表示,非正态分布变量用中位数(IQR)表示;
"Post-surgical ECMO"包括任何类型的手术(冠脉搭桥术及其他);
ECMO体外膜肺氧合;APACHE Ⅲ score 急性生理学和慢性健康状况Ⅲ评分;AMI 急性心梗;CAGS 冠脉搭桥术;VA-ECMO 静脉-动脉ECMO;VV-ECMO 静脉-静脉ECMO;RRT 肾脏替代治疗;MV 机械通气;SOFA 序贯器官衰竭评估;RBC 红细胞单位;FFP 新鲜冰冻血浆;PLT 血小板计数;ICU 重症监护病房;LOS 收住时间
出血事件
出血事件的定义是连续多日符合出血定义的出血且出血灶相同,超过203天ECMO中共发现224个出血灶,出血事件共发生128次。在149次ECMO中,发生出血事件1次的有58例(39%),2次的有14例(9%),3次的有9例(6%),4次的有5例(3%),5次的有3例(2%)。ECMO启动后首次发生出血事件的中位数时间是4天(第1-第3四分位数:0-8天)。在224个出血灶中,最常见的3个部位是ECMO置管处、心胸外科术后的血胸或心包填塞、和耳鼻喉处(ENT)(见图1)。有5例患者(2.2%)出现颅内出血,并且均未存活。在43例ECMO中有67次针对出血的特殊治疗措施,包括手术干预(56次)、血管造影(5次)、胃镜(4次)和支气管镜(2次)。此外药物治疗出血事件中,氨甲环酸用于治疗出血事件15次,重组活化因子Ⅶ 3次,凝血酶原复合物5次,纤维蛋白原浓缩物2次。

图1:出血灶分布情况。纵坐标是绝对值(n)。128次出血事件中发现有224个出血灶。Lines包括中央静脉置管。ENT 耳鼻喉;GI 胃肠道。
81次ECMO由于至少1次的出血事件使病情变得复杂。两组有无出血事件的比较中患者人口统计学资料和发病率没有统计学差异(见表1)。在ECMO期间发生出血事件更常见于术后的ECMO患者 (39 vs. 7%, P<0.001),以及ECMO启动时疾病的严重程度性,SOFA评分均值 11(第一-第三四分位数:9-14) vs. 9 (第一-第三四分位数:7-12)],以及更常见于需要RRT治疗 (64 vs. 35%, P<0.01)。在多因素分析中,无论在ECMO前还是ECMO期间,抗血小板药物和华法林均和出血事件无相关关系。
单独考虑ECMO天数,当203天满足ELSO定义的出血,而ECMO支持的1144天中没有出血。在考虑肝素和无肝素患者时,出血前记录的低Hb [均值 87g/L(95% CI 84–89)vs.93g/L (95% CI 90–95); P<0.01],低动脉pH值 [7.30(95% CI 7.28–7.32)vs.7.35(95% CI7.33–7.36);P<0.01],低离子钙 [1.02mmol/L(95% CI1.01–1.05)vs.1.09mmol/L(95% CI 1.07–1.10); P<0.01] 和高aPTT[90s(95% CI 81–98)vs.71s(95% CI 67–76); P<0.01] 与出血事件的发生率相关(见表2)。与无出血事件发生的患者比较,出血前接受肝素治疗的比例较低,但是接受肝素治疗和发生出血事件的患者有着更高的aPTT[86s(95% CI 76–95)vs.69s (95% CI 64–73), P<0.01]。比较1%9(n=12)没有发生出血天数,主动脉球囊反搏治疗发生4%(n=6)的出血天数。ECMO的类型也与出血事件相关(见表2)。
表2:比较有无出血事件的ECMO天数在生化指标和输注情况上的差异
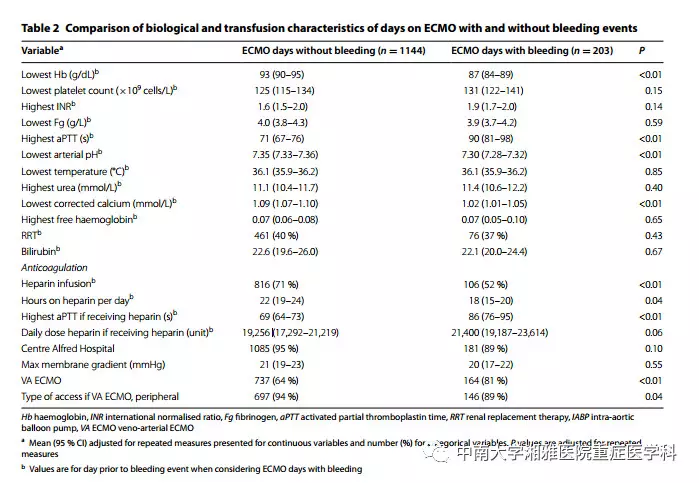
表注:Hb 血红蛋白;INR 国际标准化比值;Fg 纤维蛋白原;aPTT 活化部分凝血活酶时间;RRT 肾脏替代治疗;IABP 主动脉球囊反搏治疗;VA-ECMO 静脉-动脉 ECMO。
a Mean(95% CI)是根据重复测调整后的连续变量集中趋势的描述,number(%)是对分类变量的统计描述,P值也同样根据重复测量而调整。
b Values是ECMO期间发生出血事件前的天数
4名患者(2.7%)出现缺血性卒中,11名(7.4%)出现下肢缺血,16名由于循环问题更换了膜肺。在有无出血的组间比较中没有发现血栓事件存在统计学差异。在接受氨甲环酸或凝血因子Ⅶ的患者中,均没有出现血栓栓塞并发症。
出血事件的危险因素
对同一患者的重复测量结果校正后,高出血风险显著相关的危险因素包括:出血前高aPTT(相较于最低四分位值,最高四分位值有更显著的相关性),高APACHE Ⅲ评分和手术后ECMO。与低出血风险相关的危险因素是出血前抗凝治疗(见表3)。在校正模型中ECMO类型和出血风险没有相关性。当对75次非术后VA-ECMO患者行亚组分析时,发现出血前高aPTT仍然与出血相关 [校正的OR 3.24 (95%CI 1.11-9.44), P =0.03],及每日最低体温(见表4)。
表3:多因素回归分析中与出血相关的独立危险因素

表注:纳入了1125天的完整数据;
aPTT 活化部分凝血活酶时间;APACHE Ⅲ score 急性生理学和慢性健康状况Ⅲ评分;
a: aPTT<46s 是参考值
表4:非术后VA-ECMO患者中与出血相关的独立危险因素(共75例,根据ECMO指征和疾病严重程度校正)
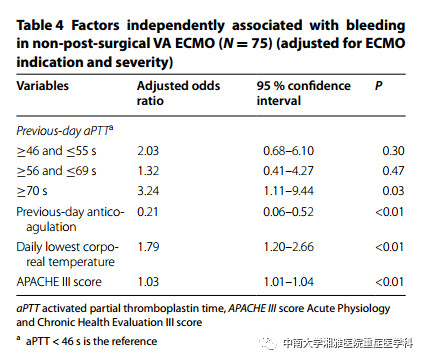
表注:aPTT 活化部分凝血活酶时间;APACHE Ⅲ score 急性生理学和慢性健康状况Ⅲ评分;
a: aPTT<46s 是参考值
预后的独立预测指标
在单因素分析中发现,出血与较差的生存相关[HR 3.04 (95%CI 1.58–5.89), P<0.01]。当将其他生存预测变量校正后,出血仍与不良生存预后相关[HR 2.17 (95%CI 1.07–4.41), P=0.03](见表5)。其他与不良生存预后相关的指标包括ECMO启动时的SOFA评分[HR 1.10 (95%CI 1.01–1.20), P=0.03] 和ECMO的指征(见表5)。当对非术后VA-ECMO患者进行亚组分析时,同样发现出血与不良预后相关[HR 3.05 (95%CI 1.11–8.38), P=0.03](见表6)。
表5:与不良预后相关的独立危险因素
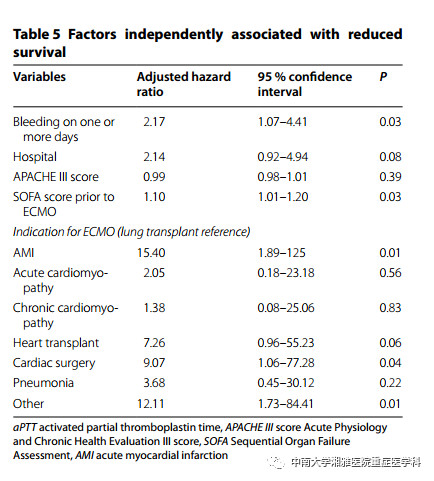
表注:aPTT 活化部分凝血活酶时间;APACHE Ⅲ score 急性生理学和慢性健康状况Ⅲ评分;SOFA 序贯器官衰竭评估;AMI 急性心梗
表6:非术后VA-ECMO患者中与不良预后相关的独立危险因素(共75例)
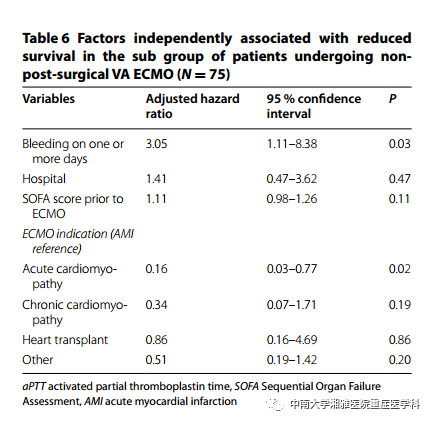
表注:aPTT 活化部分凝血活酶时间;SOFA 序贯器官衰竭评估;AMI 急性心梗
讨论
根据ELSO所定义的出血事件,发生在超过一半的ECMO支持重症患者,,且是住院死亡率强有力的独立危险因素。最常见的出血灶是ECMO置管处、心胸外科术后切口和耳鼻喉。我们发现疾病严重程度和出血前高aPTT与出血独立相关,而出血前抗凝治疗与低出血风险相关。我们的结果也强调需要更多的研究来探讨凝血异常在这类人群中的重要性。
与文献报道的比较
我们发现在ECMO期间有60%由于出血致病情复杂,高于之前研究的出血比例,原因可能是对于出血事件的诊断不同而导致。在之前文献中报道的ECMO患者中发生的出血事件既没有明确的定义,也没有报道基础器官部位受累,出血导致死亡原因,或是出血要求需要手术干预还是仅仅输注RBC。近期ELSO指南中提出了出血这一并发症的定义标准。尽管这一标准还未被ECMO相关性出血的研究所广泛使用,但它可能对我们的研究及进一步研究比较起到了推进作用。
我们发现ECMO支持患者中,手术后出血和ECMO置管处是最常见的出血源,这一结果也与之前的研究相符。然而,ENT在这类人群的出血源中不常被报道。ENT的出血很难评估其严重程度,并且其血流动力学原因也比其他部位的出血来得更“慢”一些。然而,耳鼻喉出血的诊断是必要的,因为其可能需要对原发性凝血功能障碍进行特异性的排除,如血小板功能异常和血管性血友病,以及局部止血包扎的特殊治疗。我们的研究发现ECMO期间有2.2%的患者并发ICH,这一结果与Paden等人的研究相似,但低于其他队列研究的结果。ICH在我们的研究中也可能存在漏诊的现象,这是由于CT颅脑平扫和尸检并非常规检查项目。
先前研究的出血风险因素包括ECMO启动时可用的参数(如人口统计学资料、ECMO参数、ECMO启动时患者的特点)。但是很少有研究评估ECMO期间的出血危险因素。几十年前,Kasirajan等人研究了ICH和血小板计数之间的相关关系。本次研究中,我们没有发现血栓和出血之间存在独立的相关,这可能是由于血小板计数的中位数相对过高和ICU发生率相对的过低有关。Kasirajan等人还发现了ICH和肝素治疗存在直接相关关系,但是却没有提供肝素输注的策略和凝血相关的结果。在我们的研究中,事实上如果出血的发生是在患者符合ELSO出血定义之前,这可能可以解释出血前接受肝素治疗的患者中,出血患者的所占比例低于无出血的患者,这可能会导致临床医生停止肝素输注。这也可以解释为医生选择较低风险出血的患者进行抗凝治疗,并且仍然接受肝素治疗的患者没有出血证明了抗凝治疗的耐受性。然而我们也发现,抗凝治疗的强度(由aPTT衡量)是与出血风险的增加相关(OR值随着aPTT的等级提升而增加),提示对于抗凝治疗的患者,高aPTT是有害的。这仍需进一步研究针对这类患者抗凝和出血风险。在近期的一项前瞻性观察研究中,32次VV-ECMO患者予以血栓弹力图(TEG)评估抗凝治疗的效果,aPTT和肝素治疗之间的反应时间超过90分钟(“扁线”轮廓),这些结果强调了在这类患者中优化抗凝治疗的必要性。ECMO和心脏手术均会导致纤维蛋白原水平的下降。在近期儿科ECMO和手术相关的研究中发现了低纤维蛋白原水平和出血事件存在相关关系。在一项关于重点监测和治疗凝血异常的ECMO患者的研究中,间接地发现了凝血异常在其中的关键作用。
VA-ECMO患者较于VV-ECMO患者有着不同的发病率、基础疾病以及抗凝策略。在单因素分析中VA-ECMO与更多的出血天数相关,但是在校正后却无相关关系。然而如果确实存在差异,我们可能没有办法检测。同样,根据诊断,出血风险也存在一些差异,但是在校正后的分析中却没有存在。最后,由于术后VA-ECMO的发生率高(32%),虽然手术后ECMO和ECMO类型之间没有共线性,但我们可能已经忽略了ECMO类型与出血风险之间的关联。
研究结果的应用及展望
在临床管理中出血的风险应被足够重视,包括对此类患者的有创治疗措施。虽然我们的回顾性研究在试验设计上会存在局限性,但我们发现凝血功能异常和成年ECMO患者出血之间存在相关,这一结果强调了针对此类患者监测其凝血和出血的重要性。对于ECMO医疗中心来说,需要优先制定止血指南管理ECMO期间出血及未出血患者。
开展前瞻性研究以评估优化的止血治疗策略对于出血和血栓的影响是非常必要的,止血策略包括成分输血、抗凝强度、氨甲环酸的使用、凝血因子复合物的使用和抗凝血酶Ⅲ。此外,使用血栓弹力图监测凝血功能也许会对这一类高危出血患者有益。
今后开展大型的前瞻性研究应单独将致命性出血作为独立的结局指标将会更有意义。
本研究的优势与局限性
我们的研究工作强调,由于出血并发症普遍存在以及所带来的不良预后,在ECMO患者的管理中是非常重要的一个问题。我们研究了临床、生化和治疗参数影响出血并发症的相关危险因素。我们使用明确的出血事件定义,以确保研究结果的准确性,并允许其他研究进行比较。纳入两个ECMO中心的患者增加了结果的外在效度。时间依赖的生存分析可以在ECMO启动时及ECMO过程中识别参数。
然而,我们的研究确实存在一些局限性。由于是回顾性研究设计,我们只能探讨危险因素和出血之间的关联,并无法对因果关系做出任何结论。我们也不能排除未测量的因素所造成混淆,例如置管方法。回顾性设计也可能导致出血事件的错误分类。但是,我们使用的出血定义依赖于输血量、特定部位出血和/或干预的需求,所有这些都可以从电子实验室检查结果和医疗记录中客观地获取到。由于无法确定出血开始的时间,因此我们分析了出血前1日的变量与出血的关联。此外,考虑到VV-ECMO或手术后ECMO患者的样本量较小,因此我们无法进行相关的亚组分析。最后,由于是回顾性设计,可能会出现血栓形成的漏诊。
结局
综上所述,我们的研究表明由ELSO所定义的出血事件是ECMO患者常见且严重的并发症。ECMO期间有60%发生至少一次出血并发症。ECMO期间出血与医院死亡率独立相关。在已明确的出血事件危险因素中,除外患者病情的严重程度,凝血功能异常是唯一能明确并可能被干预的因素。这些研究结果强调了进一步研究明确针对这类患者的最安全凝血管理的重要性。