成人体外膜肺氧合的应用及并发症

体外膜肺氧合(ECMO)是一种有效的体外心肺机械辅助技术,该技术将部分静脉血从体内引流至体外,经膜肺氧合后再由驱动泵将氧合的血液泵入人体内,可同时提供双心室联合呼吸功能辅助,在各种原因导致的常规治疗无效的循环衰竭和(或)呼吸衰竭的治疗中发挥了重要作用。
ECMO大大提升了患者的存活率[1,2],但由于接受ECMO治疗的患者自身病情通常极为危重,加之受ECMO本身技术特点所限,应用ECMO的患者可能面临多种并发症发生的可能[3,4],且随着ECMO使用时间的延长,患者出现并发症的风险显著增加,而并发症的出现将导致患者住院天数延长、住院费用和死亡风险增加[4]。因此,对于使用ECMO的患者应加强监测和管理,积极预防可能出现的各种并发症,做到早发现、早处理。本文就ECMO应用现况及使用过程中可能出现的并发症进行综述。
早在20世纪70年代,ECMO技术就已经用于临床危重患者的救治[5],早期主要被用于急性呼吸窘迫综合征,尤其是新生儿急性呼吸衰竭的救治[6]。由于ECMO能够提供长达数天至数周的有效心肺辅助,置入方式快捷简便,费用较Impella等其他心脏辅助方式低廉,并能够提供4~6L/min的血流量,因此近年来ECMO在危重症患者中的应用越来越广泛,尤其是在难治性心源性休克、心搏骤停、重症急性呼吸衰竭、高危经皮冠状动脉介入治疗或心脏外科手术围术期辅助治疗等领域[7,8],为恢复患者心肺功能赢得了时间。
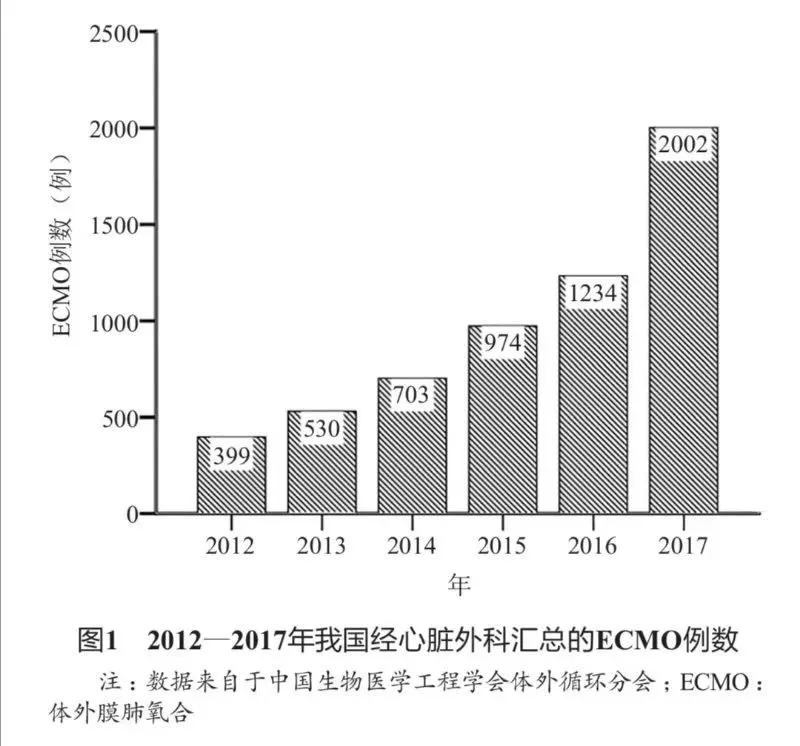
由体外生命支持组织(ExtracorporealLifeSupportOrganization,ELSO)提供的注册数据显示,截至2017年,全球已有60个国家400余家中心超过80000例患者接受过ECMO治疗[9]。而来自我国心脏外科的数据(不含呼吸重症及危重医学等专业)显示,2012—2017年,我国应用ECMO治疗的患者数量也出现了跨越式增长(图1)[10-14]。
根据血液回输方式不同,将ECMO分为静脉至动脉体外膜肺氧合(veno-arterialextracorporealmembraneoxygenation,VA-ECMO)和静脉至静脉体外膜肺氧合(veno-venousextracorporealmembraneoxygenation,VV-ECMO),前者同时具有循环和呼吸辅助作用,而后者仅具有呼吸辅助作用。
根据插管部位不同,将ECMO分为中心插管和外周插管两种形式。成人VA-ECMO最常选用股静脉-股动脉插管方式,此方式能够引流大部分回心血量,降低右心室前负荷,进而降低左心室前负荷,并提供充分的远端灌注。但由于回流至机体的血液由经股动脉置入降主动脉的导管逆行灌注,会与自身心脏搏出的血液发生抵抗,使左心室后负荷增加,衰竭的左心室不能射血,导致左房压升高和肺水肿[15,16]。可联合应用主动脉内球囊反搏(intraaorticballoonpump,IABP)或采用胸部切开直接在左心房置管或用球囊导管房间隔造口等方式将左心房血液引流入旁路循环的静脉侧,减轻左心负荷,促进左心功能恢复,预防左心室内血栓形成和肺水肿加重[17]。与此同时,如果患者自身心功能较好,则逆行的氧合后的血液就不能灌注主动脉弓;如同时存在肺功能较差,则左心室射出的未氧合的血液在主动脉弓处不能与逆行灌注的氧合血液充分混合,导致身体上半部分低氧,这种现象称为Harlequin综合征,患者可表现为上肢发绀而下肢呈粉红色。监测Harlequin综合征患者的饱和度应于其右手、前额、鼻子或右耳进行,动脉血气分析标本应从右臂动脉获取[8]。
成人VA-ECMO的适应证包括:①心搏骤停;②以下原因引起的心源性休克:急性心肌梗死、急性心肌炎、缺血性或非缺血性心肌病进展、肺栓塞导致的急性右心室衰竭、肺疾病导致右心室衰竭进展、先天性心脏病进展、心脏移植后原发性移植物衰竭及急性同种异体排斥反应、心脏毒性药物过量、脓毒症性心肌病;③难治性室性心动过速;④左心室辅助装置支持期间右心室衰竭;⑤体外循环撤机失败[8]。
VA-ECMO的绝对禁忌证包括:严重而不可逆的心脏以外的器官衰竭而影响生存(如严重缺氧性脑损伤或转移癌)、不可逆性心力衰竭且不考虑移植或长期心室辅助、主动脉夹层。相对禁忌证包括:严重凝血功能障碍或存在抗凝禁忌证(包括晚期肝病)、血管入路有限(严重的外周动脉疾病、极度肥胖、截肢等)[8]。
成人VV-ECMO的适应证包括:①任何原因(原发或继发)引起的低氧呼吸衰竭中,当死亡率≥50%时应考虑ECMO,当死亡率≥80%应进行ECMO治疗;②高气道平台压(airwayplateaupres-sure,Pplat)(>30cmH2O)机械通气时仍存在二氧化碳潴留;③严重漏气综合征;④等待肺移植的患者需要气管插管;⑤紧急的心脏或呼吸衰竭(对最佳治疗无反应的肺栓塞或气道阻塞)[18]。
VV-ECMO并无绝对禁忌证,相对禁忌证均是与预后不良有关的临床情况[18]。
根据ELSO建议,通常将ECMO的并发症分为两大类,即患者机体并发症(与治疗相关的并发症,包括手术创面及插管部位出血、栓塞、末端肢体缺血、溶血、神经系统功能异常、肾功能不全及感染等)和ECMO机械系统并发症(与ECMO管路、器材相关的并发症,主要包括氧合器氧合不良、血浆渗漏、循环管道破裂、驱动泵和热交换器功能异常等)[3,19,20]。
2013年发表的一项纳入了1763例患者的荟萃分析显示,最常见的VA-ECMO相关并发症包括:需要持续血液滤过的肾衰竭(52%)、细菌性肺炎(33%)、任何出血(33%)、需要更换的氧合器功能障碍(29%)、败血症(26%)、溶血(18%)、肝功能障碍(16%)、下肢缺血(10%)、静脉血栓形成(10%)、中枢神经系统并发症(8%)、胃肠道出血(7%)、吸入性肺炎(5%)、弥散性血管内凝血(disseminatedintravascularcoagulation,DIC)(5%)[3]。
在ECMO辅助期间,出血和血栓是最常见且显著增加患者死亡率的并发症,二者常在同一患者中共存。平衡出血和血栓形成的相对风险非常困难,因为与出/凝血相关的多种因素均与患者疾病、体外支持类型、促炎和抗炎途径之间的平衡有关,而这些因素在不同患者之间存在很大不同。
ECMO辅助期间患者处于持续高凝状态,体内各个部位,包括下肢静脉、肺静脉、膀胱、脑动脉、肢体动脉、甚至收缩运动减低的心腔内等均可形成血栓或栓塞;但由于无血管内皮覆盖、存在血液湍流等原因,包括氧合器和血泵在内的插管和管路是发生血栓最常见的部位[21,22]。确切的血栓发生率并不清楚,但尸检证实的血栓发生率远高于临床所见[22]。2014年ELSO报道显示,VA-ECMO成年患者氧合器中血栓发生率为12.9%,VV-ECMO成年患者为9.6%[21],并可导致氧合器障碍和栓塞。可于手电筒照射下通过肉眼观察管路中是否存在血栓。而每日监测D-二聚体可能提供重要信息,如出现临床不能解释的D-二聚体水平显著升高,则高度提示存在氧合器血栓的可能[23,24]。
虽然使用ECMO的患者面临着极高的血栓风险,但同时也面临着极高的出血风险,其出血发生率为12%~52%。出血是导致ECMO患者预后不良的主要原因,以手术切口或ECMO插管部位常见,也可见于机体的任何部位,包括消化道、泌尿系统、颅内、皮肤黏膜、肺、心包腔、胸腔或腹腔等,颅内出血较为严重,甚至危及患者生命。导致ECMO患者出血的原因很多,主要包括应激性溃疡、抗凝剂过量、ECMO运转带来的凝血因子破坏和血小板减少、血小板功能降低、纤溶亢进、DIC、获得性血管性假血友病因子缺乏、肝素诱导的血小板减少(heparin-inducedthrombocytopenia,HIT)等[21,25-27]。
尽管目前已广泛使用组织相容性较好的肝素涂抹管道以预防管路血栓的发生,但仍不能完全将其避免[4]。为了减少血栓的形成,通常采用肝素为ECMO患者进行抗凝治疗。2017年ELSO《体外生命支持通用指南》、2018年我国《成人体外膜氧合循环辅助专家共识》及2019年《美国心脏病学会杂志》科学专家组均建议在使用肝素时应进行凝血功能监测[7,8,28]。由于活化凝血时间(activatedclottingtime,ACT)检测快捷简便,因此常被用于床旁监测,使ACT延长至正常上限的1.5倍[28],即180~220s[8]。但ACT并不能准确监测肝素的作用,还应定期监测活化部分凝血活酶时间(activatedpartialthromboplastintime,APTT)、凝血酶原时间、纤维蛋白原、抗凝血因子Χa及血小板计数[7,25]。ECMO运转期间,应维持血小板计数>50×109/L[12],血红蛋白水平维持在80~100g/L[8],必要时可输注血小板、新鲜冰冻血浆及红细胞。当出现HIT或肝素抵抗时,可采用比伐卢定或阿加曲班进行抗凝[25],并维持APTT在50~60s。对于出血患者,可适当降低抗凝强度。中国医学科学院阜外医院的经验是,对于部分渗血较多的患者,可将其ACT维持在120~140s[4]。也有研究发现,对出血或出血高风险患者,停用抗凝药物3d也是安全的[29]。因此2017年ELSO《体外生命支持通用指南》推荐,在不能通过其他措施控制出血时,可在不进行全身抗凝的情况下管理ECMO;在无全身抗凝的患者中,血流量应维持在较高水平,如果管路中出现凝血块,则应更换管路[28]。
肢体缺血是VA-ECMO患者的严重并发症之一,典型表现为肢体苍白、脉搏消失及坏疽,少数可出现骨筋膜室综合征,严重者需要实施筋膜切开术甚至截肢[30]。可以通过肢端血氧饱和度及临床表现判断肢端缺血情况。高度怀疑存在肢体缺血的患者需要频繁进行超声多普勒检查,并每小时进行监测。肌酸激酶或乳酸水平升高通常提示病程已进展至晚期[8]。肢体缺血坏死与ECMO插管有较明确的关系,留置导管的口径太大可阻塞血流,而血栓形成和栓塞也可造成肢体缺血。
在满足心输出量需求的情况下,尽可能置入较小口径的管路可减少肢体缺血的发生。荟萃分析显示,放置远端灌注管对于减少VA-ECMO患者末端肢体缺血有显著作用,可使肢体缺血发生率由25.42%降至9.74%[31]。因此,近年来发表的国内外ECMO指南或专家共识均强烈建议在股动/静脉插管完成、连接ECMO环路获得稳定的辅助流量后,放置远端灌注管,以增加动脉插管侧下肢血液供应,预防下肢严重缺血[7,8]。
ECMO辅助的神经系统并发症主要包括脑死亡、颅内出血、脑梗死及癫痫。ELSO注册数据显示,在4988例VV-ECMO成人患者中,7.1%出现了神经系统并发症,其中脑死亡、颅内出血、脑梗死及癫痫发生率分别为2.0%、3.6%、1.7%及1.2%[32];而在4522例VA-ECMO成人患者中,神经系统并发症发生率为15.1%,其中脑死亡、颅内出血、脑梗死及癫痫发生率分别为7.9%、1.8%、3.6%及1.8%,有1.5%的患者同时出现多种神经系统并发症[33]。出现中枢神经系统并发症的患者院内死亡率显著增加[32,33]。
血栓或气体栓塞、全身抗凝及血流动力学不稳定都是导致ECMO辅助神经系统并发症的原因。对于VA-ECMO患者,当左心室功能恢复而自身肺功能仍低下时,可出现Harlequin综合征,也可导致脑缺血[8]。
如出现脑出血,应立即停止ECMO辅助,否则会加重脑出血;如出现脑梗死,应适当升高患者的血压,也可联合使用IABP,改善脑部血流灌注。
尽管不同研究报道的急性肾损伤(acutekidneyinjury,AKI)的发生率差别较大[4,34],甚至有研究报道AKI的发生率可高达80%左右[35,36],但总体来说,AKI在ECMO患者中非常常见,严重影响患者预后[37,38]。
危重患者在启动ECMO治疗前,其原发病及为了维持呼吸循环稳定而进行的相关治疗本身就可能诱发AKI,如败血症、缺血、呼吸衰竭、心力衰竭、缩血管药物等[37]。在ECMO支持期间,手术部位出血、溶血、缺血再灌注损伤、低容量、低血压、非搏动灌注、栓子形成栓塞、全身炎性反应等也可诱发或加重AKI[37,39]。
约50%的ECMO并发AKI患者需要进行肾脏替代治疗(renalreplacementtherapy,RRT)。受血流动力学稳定性和机体水平衡要求的影响,几乎所有患者均采用持续性肾脏替代治疗(continuousrenalreplacementtherapy,CRRT)[40]。RRT既可用于AKI的治疗,也可用于ECMO患者常见的容量超负荷的治疗[41]。CRRT装置可连接在ECMO环路上,以达到快速精准控制患者容量状态的效果[42]。尽管开始RRT的时机尚无明确标准,但根据目前的AKI标准,AKI1期患者即应及早启动RRT,防止继发多脏器功能衰竭。
VA-ECMO最可能的感染并发症是菌血症和败血症[43],ECMO运行时间越长,感染率越高。超过53%的成人患者在ECMO开始后14d内感染。感染性并发症患者的死亡率达到60%。插管过程中的无菌技术至关重要,特别是在紧急手术时[8]。
导致感染的主要原因包括疾病严重、肠道菌群移位、导管存在微生物定植和ECMO引起的免疫系统损伤、长时间气管插管带来的气道开放、营养不良、伤口渗血渗液带来的病原菌滋生等[42],ECMO相关的感染可见于血液、肺、插管部位、外科手术切口及尿路。就致病菌而言,其中58%~74%是革兰阴性菌,26%~39.5%是革兰阳性菌[44,45],多重耐药的鲍曼不动杆菌、铜绿假单胞菌及凝固酶阴性葡萄球菌可能是常见致病菌[42,45,46]。
鉴于ECMO辅助治疗期间感染发生率较高,应积极预防和控制。对于术后患者,根据手术级别和规定预防性使用抗菌药物,但抗菌药物的种类和使用时间尚存争议[7]。患者发生感染后及时行病原学检查,根据病原学检查结果及药敏试验结果选择敏感抗菌药物;同时严格无菌操作,做好导管管理,注意定期更换;动、静脉置管部位每日严格消毒并更换敷料。
溶血是ECMO治疗过程中的重要并发症之一,严重时可引起肾衰竭或DIC,并导致死亡率升高[47]。导致溶血的主要原因包括管路扭折、系统(泵头、管路、氧合器)血栓形成、静脉引流负压过大、动脉插管过细、长时间流量过大等[28]。溶血主要表现为血浆游离血红蛋白水平升高(>300mg/dl)和血红蛋白尿等。
一旦出现溶血,应针对其原因进行积极处理,如更换管路、氧合器或离心泵头,降低负压,减小动脉端压差等,同时碱化尿液、利尿,必要时可行血浆置换[4,48]。
ECMO的机械系统结构相对复杂,主要包括血管内插管、连接管、血泵、氧合器、供氧管、热交换器、变温水箱、监测系统、不间断电源等。任何机械结构的异常均可导致并发症。
机械系统并发症中以氧合器血浆渗漏、氧合能力下降较为常见[3,4]。血浆渗漏的发生既与氧合器材料有关,也与氧合器跨膜压差、辅助流量、血液破坏、ECMO长时间辅助等因素有关。由微孔型中空纤维膜制成的膜式氧合器发生渗漏的可能性较高;而聚甲基戊烯(poly-methyl-pentene,PMP)膜是致密中空纤维,具有疏水性,可增加血液相和气相的分离度,采用PMP膜制成的氧合器可大大降低血浆渗漏的发生率,延长氧合器使用寿命[49]。流量过大、动脉插管过细等原因可导致跨膜压差增高而发生血浆渗漏。
循环管道破裂可导致血液急剧大量丢失或气体进入血循环[3],对患者而言往往是致命的。因此,在ECMO日常维护中,必须有经过专业培训的ECMO团队人员24h值守,注意检查整个管路连接是否紧密牢固。